
当前课程知识点:基础生物化学实验 > 第三章 物质的定量测定 > 第一节 蛋白质的定量测定 > 紫外法测定蛋白质浓度的实验原理
3.2.2.2 【文本】紫外法测定蛋白质浓度的实验原理.docx---点此下载文件
前面我们已经谈过了学习蛋白质定量测定的意义,这一节我们开始学习最简单的蛋白质定量方法——紫外法的实验原理。
紫外法,又被称为紫外吸收法或紫外分光光度计法,此方法测定蛋白质的原理是基于蛋白质本身在紫外光谱区具有光吸收,且蛋白质溶液的吸光度A与蛋白质在溶液中的浓度C成正比,所以可以利用我们前面学过的比色法进行定量测定。
最常用的测定方法是280nm光吸收法,因为组成蛋白质的20种氨基酸中有三种含有芳香环结构,其中的共轭双键在紫外区有光吸收,大家还记得是哪三种氨基酸吗?
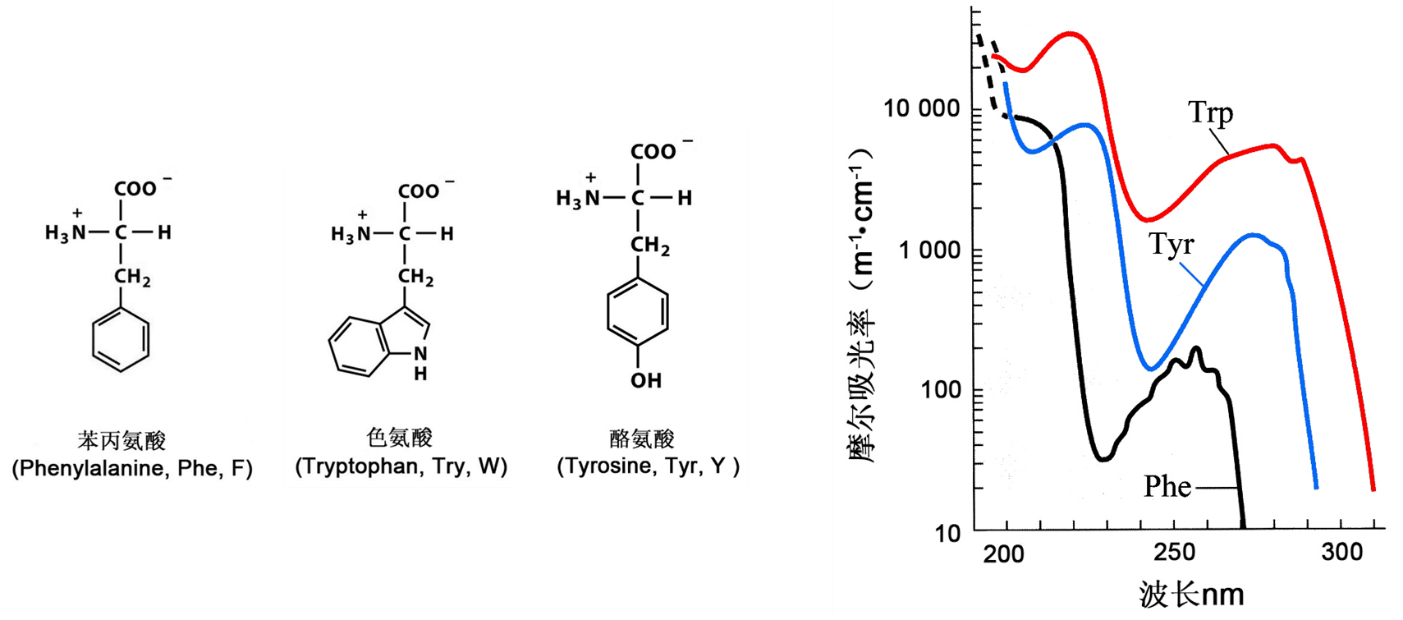
对,就是酪氨酸、色氨酸和苯丙氨酸。其中酪氨酸和色氨酸的最大吸收峰就靠近280nm。因为绝大多数蛋白质中都含有这两种氨基酸,所以绝大多数蛋白质在280nm处都具有紫外光吸收,都可以使用此方法进行定量测定。
![]()
![]() 紫外法测蛋白质的好处是不涉及化学反应,所以快速、简便,不受低浓度盐类的影响,而且测定后的蛋白质还可以回收使用,对于珍贵的纯蛋白质样品来说是非常好的测定方法。
紫外法测蛋白质的好处是不涉及化学反应,所以快速、简便,不受低浓度盐类的影响,而且测定后的蛋白质还可以回收使用,对于珍贵的纯蛋白质样品来说是非常好的测定方法。
而且对于某一种纯品蛋白来说,其摩尔消光系数(ε)是固定的,所以测定了这种蛋白溶液在280nm处的吸光度A值,就可以根据公式C=A/ε,直接计算出蛋白质的浓度。或者查得某一蛋白质的百分消光系数( ),也是一个很有用的参数,它代表某1%浓度的蛋白质溶液在光径1cm时的吸光度值,也有文献称之为百分吸收系数,写成E%。
知道了百分消光系数,我们就可以很容易的计算出某个蛋白质溶液的浓度,因为1%的蛋白质溶液浓度约为10mg/ml,所以蛋白质浓度(mg/ml)=(A280×10)/ 百分消光系数 ,
比如常用的牛血清白蛋白的百分消光系数 = 6.3,如果一份牛血清白蛋白溶液的吸光度值为0.63,那么这份溶液浓度就可以通过0.63乘以10除以6.3,即可计算出其浓度为1mg/ml。

这样通过测定紫外吸光度值方便快捷的直接计算蛋白质浓度的方法,只适用于纯蛋白溶液,也就是说只有溶液中有且只有一种蛋白质的情况,而且还需要提前查阅或计算出蛋白质的摩尔消光系数或百分消光系数。
事实上,我们经常都需要测定蛋白质混合物的浓度,或者某些无法获得这些参数的蛋白质浓度,这种情况下,就要用我们前面讲过的比色分析法,通过让未知浓度蛋白样品和标准曲线或标准品的紫外光吸收值进行比较,而计算出蛋白质的浓度。所以问题来了,不同种类的蛋白质紫外光吸收值一样吗?
事实上,不同的蛋白质酪氨酸和色氨酸含量不一样,所以单位浓度的不同蛋白质在280nm处的吸光度是有差异的,比如我们在前面计算中知道牛血清白蛋白的百分消光系数为6.3,而溶菌酶的百分消光系数为22.8,相差3倍以上,也就是1mg/ml的牛血清白蛋白其280nm处吸光度值为0.63,而1mg/ml的溶菌酶其280nm处吸光度值则会达到2.28。所以如果未知浓度样品的蛋白质中酪氨酸和色氨酸含量与标准品蛋白的差异较大,那最后计算出的结果就会产生误差。
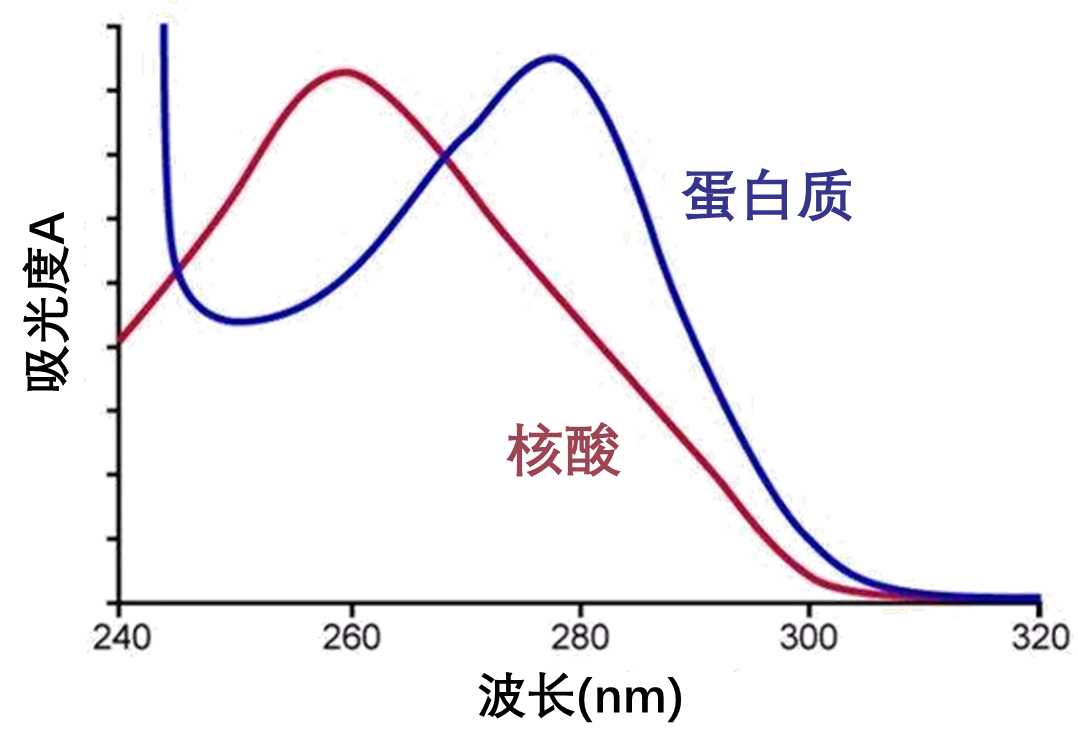
此外,生物样品粗提物中除了蛋白质,还往往含有核酸,大家还记得核酸的最大吸收峰在多少纳米吗?是的,260nm。但是从这张图上我们可以看出,核酸在280nm也具有一定的光吸收。所以如果溶液中除了蛋白质还有核酸的话,我们测定的280nm光吸收值有核酸的贡献,如果全部当做蛋白质来计算,所得数值就会比实际蛋白质浓度要高,造成较大误差。所以就需要进行校正,尽量去除核酸的影响。
常用的校正方法是利用280nm和260nm吸收差法。
已知纯蛋白质在280nm处的吸光度值约为260nm处的吸光度值的1.8倍,纯核酸在280nm处的吸光度值约为260nm处的吸光度值的0.5倍。
所以对于含有核酸的蛋白质溶液来说,可以分别测定280nm和260nm的吸光度值,然后用经验公式计算蛋白质浓度,即
蛋白质浓度(mg/ml)=1.45×A280 – 0.74×A260
请注意,这个经验公式利用不同浓度比例的酵母烯醇化酶和酵母核酸混合液所测定数据来建立的,不同的蛋白质和核酸也会有误差,所以此方法也只能用于粗略计算含有核酸的蛋白质样品浓度。
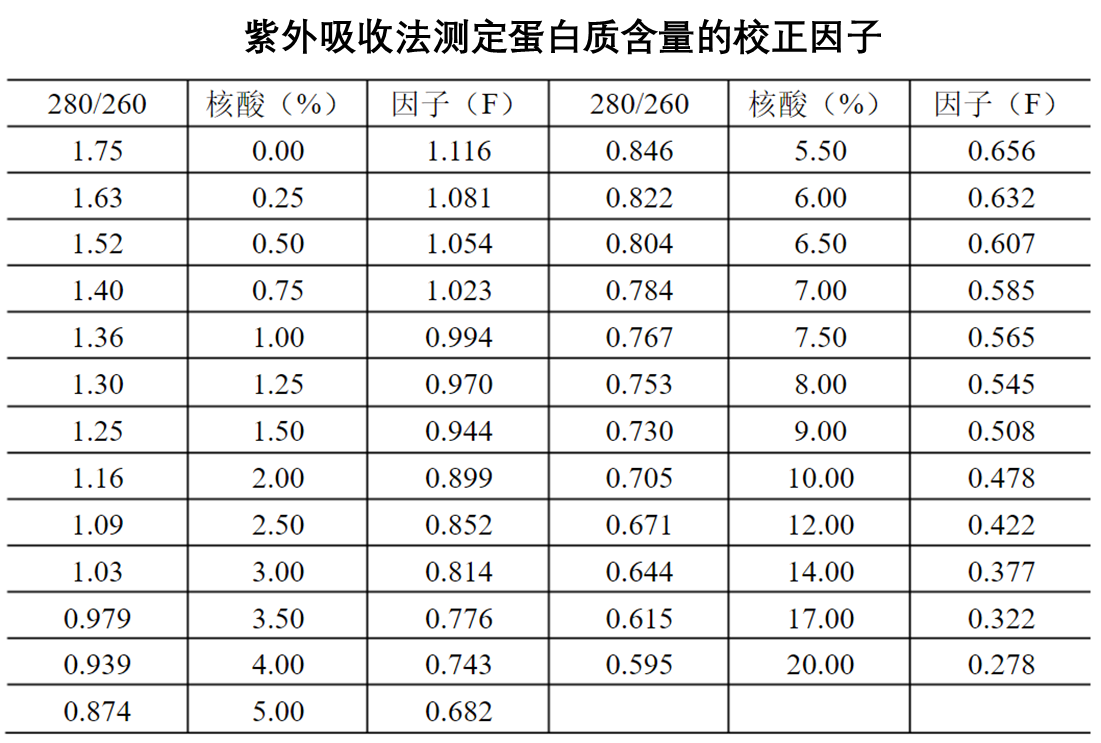
此外,也可以先计算出A280 /A260的比值,从经验表格中查出校正因子“F”的值,利用F值通过以下校正公式计算蛋白质浓度,即
蛋白质浓度(mg/ml)=F×1/d×A280
其中d为比色杯光径厚度,对于学生实验常用的1cm比色杯来说,这个公式可以简化为
蛋白质浓度(mg/ml)=F×A280
比如某样品用1cm比色杯测定的280nm的吸光度值为0.65,260nm的吸光度值为0.5,我们首先计算出280nm和260nm的吸光度比值为1.3,我们可以在表格中查出,核酸的含量大约1.25%,F值为0.97,此时蛋白质浓度为0.97×0.65,即0.63。
请注意,此表格同样是利用不同浓度比例的酵母烯醇化酶和酵母核酸混合液所测定数据来建立的,蛋白质和核酸的种类不同,或者含有其他有紫外光吸收的物质,都会导致计算误差。
此外,还有通过215nm和225nm吸光度值校正的方法,和测定238nm吸光度值的肽键校正法,但都存在误差,此处就不详细介绍了,感兴趣的同学可以自己查阅资料学习。
总结来说,利用紫外光吸收测定蛋白质浓度的方法中,最常用的还是利用标准曲线法比色测定,而最佳适用样品时经过纯化后得到的纯蛋白质溶液。在下一节中,我们将一起学习利用标准曲线法测定蛋白质紫外吸光度值,并计算蛋白质溶液浓度的具体操作方法。
-第一节 基础生物化学实验学什么?
-第二节 本课程评分标准
--本课程评分标准
-第三节 如何更好的完成本课程的学习?
-第四节 生化实验室安全注意事项
-第五节 本课程教学团队介绍
--本课程团队介绍
-第六节 课前须知作业
-第一章 课前须知 作业
-第一节 移液器的设计原理和使用规范
-第二节 移液器的操作要点
--移液器的操作要点
--移液器的操作要点
--移液器的日常校准
--移液器的日常校准
-第二章 移液器的使用 作业
--第二章 移液器的使用 作业
-第三节 分光光度计的设计原理和使用规范
-第四节 分光光度计的操作要点
-第五节 分光光度法测定待测物浓度
--分光光度法的原理
--分光光度法的原理
-第六节 荧光分光光度计的原理和使用规范
-第二章 分光光度计的使用 作业
--第二章 分光光度计的使用 作业
-第七节 离心机的设计原理和使用规范
--离心机的操作要点
--离心机的操作要点
-第二章 离心机的使用 作业
--第二章 离心机的使用 作业
-第一节 蛋白质的定量测定
-第三节 其他物质的测定
-第三章 物质的定量测定 作业
--第三章 物质的定量测定 作业
-第一节 酶活力测定的常用方法
-第二节 菠萝蛋白酶活力的测定
-第三节 酶米氏常数的测定
-第四章 酶活力的测定 作业
--第四章 酶活力的测定 作业
-第一节 蛋白质分离纯化的常见技术
--蛋白质的盐析提纯
--蛋白质的盐析提纯
--盐析操作注意事项
--盐析操作注意事项
--离子交换层析
--离子交换层析
--亲和层析
--亲和层析
--IMAC亲和层析
--IMAC亲和层析
--第五章 第一节 蛋白质的分离纯化 作业
-第二节 核酸的提取和检测
--第五章 第二节 核酸的提取 作业
-第一节 核酸琼脂糖凝胶电泳
--核酸琼脂糖电泳-作业
-第二节 聚丙烯酰胺凝胶电泳
--SDS-PAGE的原理和操作-作业
-《基础生物化学实验》期末考试



