
当前课程知识点:基础生物化学实验 > 第三章 物质的定量测定 > 第一节 蛋白质的定量测定 > Bradford法测定蛋白质的浓度的实验原理和操作方法
对,就是紫外法,双缩脲法和lowry法,也就是Folin酚法。其中紫外法干扰多,双缩脲法灵敏度低,Folin酚法灵敏度很高但需要近1个小时的时间。
今天我们来学习第四种蛋白质浓度测定的方法,Bradford法,这是一种又灵敏又快速的方法。下面,我们一起来看看这种方法是怎么回事吧。
这个方法是Marion M. Bradford在1976年建立并发表的,其主要试剂是考马斯亮蓝G-250(Coomassie Brilliant Blue G-250)这样一种有机染料,所以此方法常被称为Bradford法或考马斯亮蓝法。
考马斯亮蓝G-250染料有三种形式:阴离子呈现蓝色,中性为绿色,而阳离子为红色,在酸性条件下,染料与蛋白质中的精氨酰、赖氨酰、组氨酰、酪氨酰、苯丙氨酰、色氨酰等残基通过静电相互作用和范德华力相结合,这种结合大约需要2min即可完成,结合后,染料从棕色变为蓝色,最大光吸收波长从465 nm转为595 nm,此颜色在1小时内保持稳定,不过在5-20min的范围内颜色稳定性最好。595 nm处吸光度的增加与结合染料的量成正比,也就与样品中的蛋白质的浓度成正比,所以我们可以通过测定595 nm处吸光度来计算溶液中蛋白质的浓度。
实验室配制考马斯亮蓝G-250染液很方便,只需要称取100 mg考马斯亮蓝G-250,溶于50 ml 95%乙醇中,这个过程可适当延长时间确保染料充分溶解。然后加入85%的磷酸100 ml,调至酸性环境,然后用纯水定容到1 L,考马斯亮蓝染液配好后一定要用滤纸过滤去除不溶的颗粒,避免对测定产生影响。
设计标准曲线时,可以使用0.1 mg/ml的标准蛋白质溶液,配制1 ml的0~0.1 mg/ml的一系列标准蛋白,并将待测样制作3个以上1 ml的平行样,按照1:5的比例与考马斯亮蓝G-250染液发生反应,在5-20 min内测定595 nm的吸光度A值。

或者使用1 mg/ml的标准蛋白质溶液,配制0.1 ml的0~1 mg/ml的一系列标准蛋白,并将待测样制作3个以上0.1 ml的平行样,按照1:50的比例与考马斯亮蓝G-250染液发生反应,在5-20 min内测定595 nm的吸光度A值。

Bradford法相比其他方法具有以下优点:
第一,其操作非常便捷,只需加入一种试剂,在5-20min内完成测试即可;
第二,此方法灵敏度高于我们以前学过的其他方法,最低可检测到1 μg的蛋白质;
第三,这种方法的干扰物质较少,NaCl、KCl、MgCl2、乙醇、硫酸铵等试剂均对测定没有影响。
不过,Bradford法也并非十全十美,
首先,碱性物质、去垢剂、Tris和EDTA等试剂对测定有一定影响,需要用对照扣除;
其次,不同种类的蛋白质,所含显色氨基酸不同,其吸光度也有所差异。
比如牛血清白蛋白(BSA)的吸光度值几乎相当于牛丙种球蛋白(IgG)的两倍,此方法一般推荐采用IgG、溶菌酶或卵清蛋白作为标准品,因为这几种蛋白质中所含显色氨基酸的量和大多数蛋白质比较接近,而BSA则高于一般蛋白质。
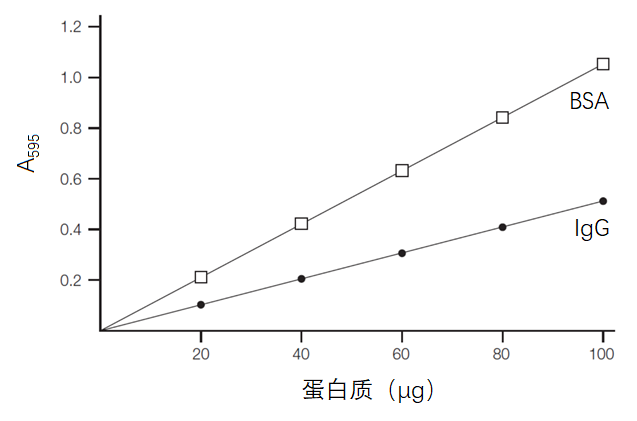
最后,因为考马斯亮蓝G-250染料本身两种颜色的光谱有一定重叠,与蛋白质结合时会引起背景颜色光吸收的变化,所以当蛋白质浓度较高的时候标准曲线会稍有弯曲,但弯曲的程度很轻,不影响测定。
-第一节 基础生物化学实验学什么?
-第二节 本课程评分标准
--本课程评分标准
-第三节 如何更好的完成本课程的学习?
-第四节 生化实验室安全注意事项
-第五节 本课程教学团队介绍
--本课程团队介绍
-第六节 课前须知作业
-第一章 课前须知 作业
-第一节 移液器的设计原理和使用规范
-第二节 移液器的操作要点
--移液器的操作要点
--移液器的操作要点
--移液器的日常校准
--移液器的日常校准
-第二章 移液器的使用 作业
--第二章 移液器的使用 作业
-第三节 分光光度计的设计原理和使用规范
-第四节 分光光度计的操作要点
-第五节 分光光度法测定待测物浓度
--分光光度法的原理
--分光光度法的原理
-第六节 荧光分光光度计的原理和使用规范
-第二章 分光光度计的使用 作业
--第二章 分光光度计的使用 作业
-第七节 离心机的设计原理和使用规范
--离心机的操作要点
--离心机的操作要点
-第二章 离心机的使用 作业
--第二章 离心机的使用 作业
-第一节 蛋白质的定量测定
-第三节 其他物质的测定
-第三章 物质的定量测定 作业
--第三章 物质的定量测定 作业
-第一节 酶活力测定的常用方法
-第二节 菠萝蛋白酶活力的测定
-第三节 酶米氏常数的测定
-第四章 酶活力的测定 作业
--第四章 酶活力的测定 作业
-第一节 蛋白质分离纯化的常见技术
--蛋白质的盐析提纯
--蛋白质的盐析提纯
--盐析操作注意事项
--盐析操作注意事项
--离子交换层析
--离子交换层析
--亲和层析
--亲和层析
--IMAC亲和层析
--IMAC亲和层析
--第五章 第一节 蛋白质的分离纯化 作业
-第二节 核酸的提取和检测
--第五章 第二节 核酸的提取 作业
-第一节 核酸琼脂糖凝胶电泳
--核酸琼脂糖电泳-作业
-第二节 聚丙烯酰胺凝胶电泳
--SDS-PAGE的原理和操作-作业
-《基础生物化学实验》期末考试



