
当前课程知识点:基础生物化学实验 > 第四章 酶活力的测定 > 第三节 酶米氏常数的测定 > 淀粉酶米氏常数的测定和计算
学过《生物化学》酶学部分,我们都已了解底物浓度会影响酶促反应速率,而酶动力学研究的核心就是底物浓度与酶促反应速率变化的关系。
从1913年两位科学家提出M-M模型以后,1925年另外两位科学家进一步完善了此数学模型,建立了同学们已经熟悉的米氏方程,
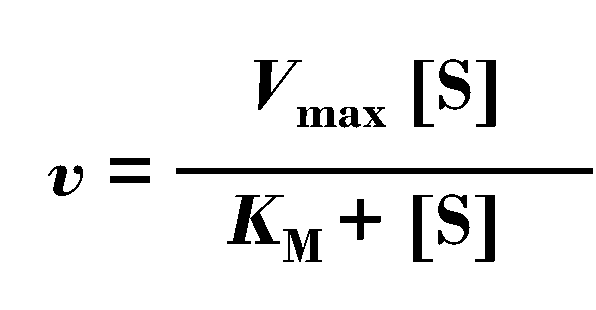
其中其中KM为米氏常数,Vmax为最大反应速率,[S]为底物浓度,v为反应速度。
米氏常数KM是米氏酶的特征常数,同一个酶对不同的底物有不同的KM,其中KM越低意味着酶与此底物亲和力越大,所以通过测定KM可以判断酶的最适底物,还可以通过KM判断反应方向。
1934年,两位科学家进一步提出将米氏方程取倒数后推导出此公式,
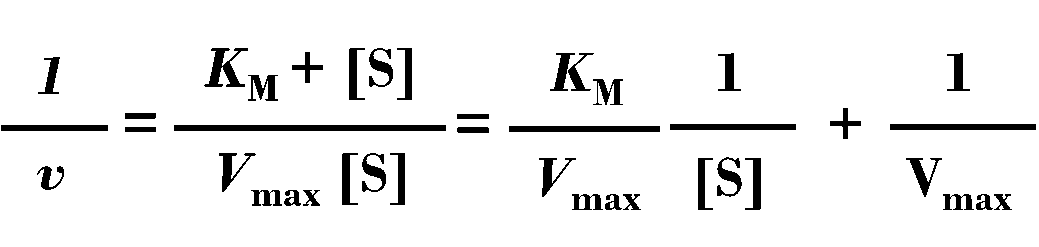
在此公式中,KM/Vmax是一个常数,1/Vmax也是一个常数,而酶促反应速率1/v和底物浓度倒数1/[S]都是变量,所以当配制一系列不同底物浓度的反应体系加入等量的酶后,计算对应的反应速度,做图就可以得到一条直线,此直线的纵轴截距等于1/Vmax,横轴截距的值为1/KM,由此就可以计算出此酶的KM和Vmax两个重要常数。但是,很多同学在实际测定和计算的过程中,关于底物浓度和反应速度计算体系容易有所混淆,所以我们这里以α-淀粉酶为例,一起来看一下如何用双倒数作图法计算酶的米氏常数。
我们以α-淀粉酶水解淀粉,利用3,5-二硝基水杨酸测定产物麦芽糖浓度的方法为例,在此反应中,首先配制一系列不同浓度的底物淀粉溶液3 ml,淀粉液用酶的最适反应溶剂体系配制,预热到40℃,在每只试管中加入1ml等温的酶液,反应5分钟后,在各管中均加入4ml NaOH使反应终止,将8 ml酶反应体系中的反应液转移1 ml到新试管,与麦芽糖标准曲线一起加入3,5-二硝基水杨酸,沸水浴加热5 min,然后稀释定容到15 ml,利用可见光分光光度计在520 nm处测定吸光度值。
根据一系列浓度梯度的麦芽糖标准曲线与3,5-二硝基水杨酸反应生成的3-氨基5-硝基水杨酸在520 nm处的吸光度值,我们可以计算出麦芽糖浓度与吸光度的对应关系。
接下来我们来看不同底物浓度的酶反应管。我们利用10mg/ml的淀粉标准液和柠檬酸缓冲液配制一系列不同淀粉浓度的溶液,接下来我们先计算公式中的底物浓度,所以第一个问题来了,底物浓度应该是淀粉加柠檬酸的3 ml体系中的淀粉浓度还是淀粉加柠檬酸再加酶液的4 ml体系中的浓度呢?
注意:和酶起反应的底物一定是混合了酶液的底物,所以,能体现差异的底物浓度,必须是即有底物又有酶液的酶反应体系中的底物浓度。
所以我们的计算方式应该是淀粉体积 (ml) × 10 mg/ml ÷ 4 ml,并由此计算出底物浓度的倒数。
我们对一系列不同底物的酶促反应管进行测定后得到其产物在520 nm处的光吸收,可计算出所测定的各管中麦芽糖的浓度,请注意:计算1-10号管的麦芽糖浓度时需要先扣除对照管的吸光度,因为这代表体系背景的光吸收。
接下来,第二个问题来了:通过与标准曲线比对计算出的产物麦芽糖浓度应该是加入淀粉、酶和NaOH后总共8 ml体系中的产物浓度,而我们知道,反应速度是单位时间内生成产物的浓度,那么是不是这个计算出的浓度除以酶促反应时间5 min就是反应速度了呢?
请注意,产物浓度也应该是酶反应体系中的产物浓度,也就是要换算到只有淀粉和酶液的反应体系中,单位时间所生成的产物浓度,在米氏方程作图过程中,只有底物和产物的浓度都是以相同体系计算才有可比性,我们可以反过来想,如果关于反应速度的计算不用换算为反应体系中的浓度,那么在反应终止的过程中,加入NaOH的量变化,反应速度就会相应变化,这是不是很不合理?
本实验中反应体系是3 ml淀粉加1 ml酶液的4 ml,而我们刚刚利用标准曲线计算的产物浓度是3 ml淀粉加1 ml酶液再加4 ml NaOH总共8 ml体系中的麦芽糖浓度,所以需要将此浓度乘以8 ml再除以4 ml,得到的才是反应体系中生成的产物浓度,在此基础上除以反应时间5 min,即可得出反应速度,并进而求出反应速度的倒数。
现在我们就计算出了不同底物浓度下的反应速度,用底物浓度和速度的倒数分别作为横纵坐标,绘制双倒数图,并且得到了此直线的斜率和截距,现在考考你,5.6853和0.9978两个数各代表什么常数,如何计算KM和Vmax呢?
根据双倒数作图的公式,我们可以知道纵轴截距的值应该等于1/Vmax,而斜率除以截距就等于KM的值。这就是米氏方程双倒数作图的基本过程。
在设计和实施米氏方程双倒数作图法求KM值的过程中,同学们要注意几点:
首先是底物浓度的设计的环节,在一定浓度范围内,为了计算方便和减少误差,可尽量避免选择倒数为无限循环小数;
此外,无论是计算底物浓度还是通过产物浓度计算反应速度,注意计算体系应该是酶反应体系;
第三点是,实际操作过程中,应注意各管之间加入酶液和终止反应的时间差,尽可能确保每只试管中的反应时间一致,否则将难以得到准确的KM和Vmax数据。
-第一节 基础生物化学实验学什么?
-第二节 本课程评分标准
--本课程评分标准
-第三节 如何更好的完成本课程的学习?
-第四节 生化实验室安全注意事项
-第五节 本课程教学团队介绍
--本课程团队介绍
-第六节 课前须知作业
-第一章 课前须知 作业
-第一节 移液器的设计原理和使用规范
-第二节 移液器的操作要点
--移液器的操作要点
--移液器的操作要点
--移液器的日常校准
--移液器的日常校准
-第二章 移液器的使用 作业
--第二章 移液器的使用 作业
-第三节 分光光度计的设计原理和使用规范
-第四节 分光光度计的操作要点
-第五节 分光光度法测定待测物浓度
--分光光度法的原理
--分光光度法的原理
-第六节 荧光分光光度计的原理和使用规范
-第二章 分光光度计的使用 作业
--第二章 分光光度计的使用 作业
-第七节 离心机的设计原理和使用规范
--离心机的操作要点
--离心机的操作要点
-第二章 离心机的使用 作业
--第二章 离心机的使用 作业
-第一节 蛋白质的定量测定
-第三节 其他物质的测定
-第三章 物质的定量测定 作业
--第三章 物质的定量测定 作业
-第一节 酶活力测定的常用方法
-第二节 菠萝蛋白酶活力的测定
-第三节 酶米氏常数的测定
-第四章 酶活力的测定 作业
--第四章 酶活力的测定 作业
-第一节 蛋白质分离纯化的常见技术
--蛋白质的盐析提纯
--蛋白质的盐析提纯
--盐析操作注意事项
--盐析操作注意事项
--离子交换层析
--离子交换层析
--亲和层析
--亲和层析
--IMAC亲和层析
--IMAC亲和层析
--第五章 第一节 蛋白质的分离纯化 作业
-第二节 核酸的提取和检测
--第五章 第二节 核酸的提取 作业
-第一节 核酸琼脂糖凝胶电泳
--核酸琼脂糖电泳-作业
-第二节 聚丙烯酰胺凝胶电泳
--SDS-PAGE的原理和操作-作业
-《基础生物化学实验》期末考试


